Vyhláška kterou se mění vyhláška č. 343/1997 Sb., kterou se stanoví způsob předepisování léčivých přípravků, náležitosti lékařských předpisů a pravidla jejich používání, ve znění pozdějších předpisů
Ministerstvo zdravotnictví v dohodě s Ministerstvem zemědělství, Ministerstvem obrany, Ministerstvem vnitra a Ministerstvem spravedlnosti stanoví podle § 75 odst. 3 zákona č. 79/1997 Sb. , o léčivech a o změnách a doplnění některých souvisejících zákonů:
1. Nadpis § 1 zní: "Úvodní ustanovení ".
2. V § 1 se vkládá nový odstavec 1, který včetně poznámky pod čarou č. 1) zní:
"(1) Tato vyhláška Ministerstva zdravotnictví stanoví v souladu s právem Evropských společenství, 1) způsob předepisování léčivých přípravků, náležitosti lékařských předpisů a pravidla jejich používání.
1) Směrnice Rady 90/167/EHS, kterou se stanoví podmínky pro přípravu, uvádění na trh a používání medikovaných krmiv ve Společenství. Směrnice Evropského parlamentu a Rady 2001/82/ES o kodexu Společenství týkajícím se veterinárních léčivých přípravků. ".
Dosavadní text se označuje jako odstavec 2 a dosavadní poznámka pod čarou č. 1) se označuje jako poznámka pod čarou č. 1a), a to včetně odkazů na poznámku pod čarou.
3. V § 1 odst. 2 písm. a) se na konci textu bodu 2 doplňují slova "vzor tiskopisu receptu je uveden v příloze č. 3 této vyhlášky ".
4. V § 1 odst. 2 písm. b) se za slovo "objednávky" vkládají slova "léčivých přípravků, včetně transfúzních přípravků ".
5. V § 2 odst. 2 se slova "příslušné pojišťovně" nahrazují slovy "zdravotním pojišťovnám a krajskému úřadu, příslušnému podle místa provozování zdravotnického zařízení ".
6. V § 2a odst. 8 se za slova "označených modrým pruhem" vkládají slova ",včetně jejich průpisů, ".
7. V § 2a odst. 9 se za slova "označených modrým pruhem" a za slova "znehodnocené tiskopisy" vkládají slova "včetně jejich průpisů, ".
8. Za § 2a odst. 10 se za slova "označených modrým pruhem" vkládají slova "včetně jejich průpisů, ".
9. V § 3 odst. 1 písm. a) se slova "nebo flunitrazepam" zrušují.
"(2) Na jednu žádanku lze předepsat nejvýše pět druhů léčivých přípravků, které obsahují omamné látky skupiny I 2) nebo psychotropní látky skupiny II. 3)".
11. V § 3 odst. 3 se slovo "více" zrušuje.
12. V § 4 odst. 1 písm. c) bod 2 zní:
"2. individuálně připravovaného léčivého přípravku s použitím lékopisných názvů nebo jejich synonym nebo zkratek uvedených v lékopisu, ".
13. V § 4 odst. 1 písm. d) bodu 1 se slova "určeného vyhláškou7)" nahrazují slovy "určeného lékopisem 7)".
Poznámka pod čarou č. 7) zní:
"7) § 7 písm. d) a e) zákona č. 79/1997 Sb. , o léčivech a o změnách a doplnění některých souvisejících zákonů, ve znění zákona č. 149/2000 Sb. a zákona č. 129/2003 Sb. ".
14. V § 4 odst. 1 písm. d) bod 3 zní:
"3.
"I" - jde-li o léčivý přípravek plně hrazený ze zdravotního pojištění,
"C" - jde-li o léčivý přípravek částečně hrazený ze zdravotního pojištění,
"P" - jde-li o léčivý přípravek plně hrazený pacientem,
".
15. V § 4 odst. 1 písm. d) se bod 5 zrušuje.
16. V § 4 odst. 2 se slova " , který není příslušným odborným lékařem" nahrazují slovy "jiné odbornosti ".
17. V § 4 odst. 2 písmeno b) zní:
"b) obsahovat na zadní straně jméno, příjmení a odbornost lékaře, který předpis léčivého přípravku doporučil. ".
"(3) K částečné úhradě pacientem se předepisují léčivé přípravky označené na receptu symbolem "C" a k plné úhradě pacientem se předepisují léčivé přípravky označené na receptu symbolem "P", a to v souladu s § 3 a § 4 odst. 1 písm. b) až h) . ".
19. V § 4 odst. 5 se na konci věty prvé zrušují slova "a době platnosti" a věta třetí se nahrazuje větou "Opakování výdeje nesmí být vyznačeno na receptu při předepisování léčivých přípravků obsahujících omamné látky, psychotropní látky, efedrin nebo pseudoefedrin v množství větším než 30 mg v jednotce lékové formy. ".
20. V § 4 odst. 6 se v úvodní části textu slova "na přední straně receptu předepisujícím lékařem vyznačen symbol "Rev." a" zrušují.
21. V § 4 odst. 6 písm. b) se za slova "jeho předběžného souhlasu" vkládají slova "nebo schválení opakovaného předepisování " a za slova "udělení předběžného souhlasu" se vkládají slova "nebo souhlasu s opakovaným předepisováním ".
22. V § 4 se doplňuje odstavec 7, který včetně poznámky pod čarou č. 7a) zní:
"(7) Recept na humánní léčivé přípravky předepsaný lékařem poskytujícím zdravotní péči sobě, manželovi, svým rodičům, prarodičům, dětem, vnukům a sourozencům, jestliže jeho odbornost zaručuje Česká lékařská komora nebo Česká stomatologická komora, 7a) obsahuje náležitosti podle odstavce 1 písm. a) až e) a písm. g) až h) a musí být opatřen poznámkou "pro potřebu rodiny".
7a) § 17 odst. 13 písm. a) zákona č. 48/1997 Sb. ".
23. V § 6 odst. 1 písm. b) bod 2 zní:
"2. individuálně připravovaného léčivého přípravku s použitím lékopisných názvů nebo jejich synonym nebo zkratek uvedených v lékopisu, ".
24. V § 6 odst. 2 se slova "výpočetní technikou" nahrazují slovy "elektronickými prostředky ".
25. V § 6 odst. 2 písm. a) se za slovo "písmen" vkládá písmeno "d), ".
26. V § 6 se doplňují odstavce 4 až 6, které znějí:
"(4) Žádanka na transfúzní přípravky musí obsahovat tyto náležitosti:
a) název poskytovatele, IČO, oddělení, IČP,
b) jméno, příjmení, datum narození, popřípadě rodné číslo plánovaného příjemce transfúzního přípravku. V případě, že nejsou potřebné údaje známy, musí být uveden údaj jednoznačně identifikující plánovaného příjemce,
c) důvod podání transfúzního přípravku nebo diagnózu,
d) krevní skupinu [ABO a Rh(D)],
e) transfúzní anamnézu: předchozí transfúze, porody, těhotenství apod.,
f) druh transfúzního přípravku (jmenovitě uvedeného), počet v ks nebo TU, den a hodina podání,
g) popřípadě další úpravu transfúzního přípravku (např. deleukotizace, ozáření apod.),
h) otisk razítka poskytovatele,
j) jméno, příjmení a podpis lékaře, který požaduje transfúzní přípravek.
(5) V případě, že je současně požadováno imunohematologické vyšetření a je přiložen vzorek, musí být na žádance na transfúzní přípravky kromě údajů uvedených v odstavci 4 dále uvedeno:
a) druh požadovaného vyšetření (např. vyšetření krevní skupiny, nepravidelných protilátek, zkouška slučitelnosti),
c) jméno osoby, která vzorek odebrala,
d) číselný kód zdravotní pojišťovny příjemce transfúzního přípravku.
Vzorek k laboratornímu vyšetření musí být nezaměnitelně označen a správnost údajů musí být ověřena podpisem osoby, která vzorek odebrala.
(6) Žádanka na transfúzní přípravky uplatněná výpočetní technikou musí obsahovat náležitosti uvedené v odstavci 4 písm. a) až j) , popřípadě v odstavci 5 písm. a) až d) s tím, že autorizace podle písmen h) a j) se zjišťuje jiným jednoznačným způsobem. ".
27. V § 7 odst. 1 se na konci písmene a) doplňují slova "pokud nejde o léčivé přípravky pro místní použití ".
28. V § 7 odst. 1 písmeno b) zní:
"b) ostatní léčivé přípravky sedm kalendářních dnů, neurčí-li předepisující lékař jinak, počínaje dnem jeho vystavení, ".
"(2) Recept na opakovaný výdej má platnost nejdéle 6 měsíců počínaje dnem jeho vystavení. ".
30. V § 7 odst. 4 se slovo "pět" nahrazuje slovem "sedm ".
31. V § 8 se na konci odstavce 1 doplňuje věta "Obdobně se postupuje v případě opakovaného výdeje podle § 4 odst. 5 , pokud je recept nezbytným dokladem pro účely kontroly. ".
32. V § 8 odst. 3 se za slova "receptu se" vkládají slova "s výjimkou opakovaných výdejů ".
33. V § 9 se dosavadní text označuje jako odstavec 1 a doplňuje se odstavec 2, který zní:
"(2) Průpis vystaveného receptu podle § 1 odst. 2 písm. a) bodů 2 a 3 obsahující náležitosti podle § 4 a 5 je součástí zdravotnické dokumentace vedené o nemocném. Průpis odeslané žádanky podle § 1 odst. 2 písm. b) obsahující náležitosti podle § 6 je součástí spisové dokumentace příslušného oddělení poskytovatele. ".
34. V § 13 odst. 1 písmeno f) včetně poznámky pod čarou č. 9) zní:
"f) otisk razítka obsahujícího jméno, popřípadě jména, příjmení (jmenovku) a místo podnikání předepisujícího veterinárního lékaře; pokud veterinární lékař vykonává odbornou veterinární činnost 9) jako zaměstnanec fyzické či právnické osoby oprávněné vykonávat odbornou veterinární činnost, uvádí se dále jméno, příjmení a trvalý pobyt této osoby, jde-li o fyzickou osobu, nebo název a sídlo, jde-li o právnickou osobu, a
9) Zákon č. 166/1999 Sb. , o veterinární péči a o změně některých souvisejících zákonů (veterinární zákon), ve znění zákona č. 29/2000 Sb. , zákona č. 154/2000 Sb. , zákona č. 102/2001 Sb. , zákona č. 120/2002 Sb. , zákona č. 76/2002 Sb. , zákona č. 309/2002 Sb. , zákona č. 320/2002 Sb. a zákona č. 131/2003 Sb. ".
35. V § 13 odst. 3 se slova "a u distributora" zrušují.
36. § 14 včetně nadpisu a poznámek pod čarou č. 10) a 11) zní:
"§ 14 Náležitosti předpisů pro medikovaná krmiva a nakládání s nimi
(1) Předpis pro medikované krmivo 10) obsahuje nejméně tyto náležitosti:
a) jméno, příjmení a místo podnikání předepisujícího veterinárního lékaře,
b) název medikovaného premixu, který má být použit pro výrobu medikovaného krmiva, včetně uvedení síly,
c) koncentraci léčivé látky v medikovaném krmivu,
d) jméno, příjmení a místo podnikání chovatele zvířete, u kterého má být medikované krmivo použito, jde-li o fyzickou osobu, nebo název a sídlo, jde-li o právnickou osobu,
e) jméno, příjmení a místo podnikání osoby, která je příjemcem medikovaného krmiva, jde-li o fyzickou osobu, nebo název a sídlo, jde-li o právnickou osobu ( § 41k odst. 13 zákona ),
f) identifikace hospodářství, 4) kde má být medikované krmivo použito,
g) druh, kategorie a počet zvířat, pro která má být medikované krmivo vyrobeno,
h) léčebná (preventivní) indikace,
i) množství medikovaného krmiva,
j) způsob a dobu zkrmování medikovaného krmiva, včetně údaje frekvencí podávání a o množství, ve kterém je medikované krmivo zařazováno do denní krmné dávky, pokud medikované krmivo není zkrmováno jako jediné krmivo,
k) jméno, příjmení a místo podnikání výrobce medikovaného krmiva, jde-li o fyzickou osobu, nebo název a sídlo, jde-li o právnickou osobu,
l) pokyny pro chovatele zvířat, včetně zvláštních upozornění,
m) datum vystavení předpisu pro medikované krmivo,
n) údaj "Výrobu či uvedení medikovaného krmiva do oběhu nelze na tento předpis pro medikované krmivo opakovat",
o) otisk razítka obsahujícího jméno, příjmení (jmenovku) a místo podnikání předepisujícího veterinárního lékaře; pokud veterinární lékař vykonává odbornou veterinární činnost jako zaměstnanec fyzické či právnické osoby oprávněné vykonávat odbornou veterinární činnost, uvádí se dále jméno, příjmení a místo podnikání této osoby, jde-li o fyzickou osobu, nebo název a sídlo, jde-li o právnickou osobu, a
p) podpis veterinárního lékaře, který předpis pro medikované krmivo vystavil.
Předpis pro medikované krmivo se vyhotovuje podle vzoru předpisu pro medikované krmivo, který zveřejní Ústav pro státní kontrolu veterinárních biopreparátů a léčiv ve svém informačním prostředku.
(2) Předpis pro výrobu medikovaného krmiva vypracuje veterinární lékař v pěti vyhotoveních. Jedno vyhotovení uchovává veterinární lékař, který předpis pro medikované krmivo vystavil, ostatní čtyři vyhotovení předpisu pro medikované krmivo předává veterinární lékař výrobci medikovaného krmiva.
(3) Výrobce medikovaného krmiva jedno vyhotovení předpisu pro medikované krmivo uchovává, jedno vyhotovení předá Krajské veterinární správě, která je místně příslušná hospodářství, kde má být medikované krmivo použito, a dvě vyhotovení předpisu pro medikované krmivo dále předá distributorovi medikovaného krmiva, v případě, že výrobce zajišťuje sám distribuci medikovaného krmiva, které vyrobil, uchovává výrobce medikovaného krmiva rovněž vyhotovení předpisu pro medikované krmivo určené pro distributora.
(4) Distributor medikovaného krmiva, nebo jde-li o případ podle odstavce 3 , výrobce medikovaného krmiva, jedno vyhotovení předpisu pro medikované krmivo uchovává a dále předá jedno vyhotovení osobě, která je uvedena v předpisu pro medikované krmivo jako jeho příjemce; je-li příjemcem medikovaného krmiva veterinární lékař, který předpis pro medikované krmivo vystavil, předá tento veterinární lékař při použití medikovaného krmiva toto vyhotovení předpisu pro medikované krmivo chovateli.
(5) Veterinární lékař, který předpis pro medikované krmivo vystavil, a chovatel uchovávají příslušná vyhotovení předpisu po dobu nejméně pěti roků od data jeho vystavení.
(6) Výrobce medikovaného krmiva a distributor medikovaného krmiva uchovávají příslušná vyhotovení předpisů pro medikovaná krmiva v souladu s požadavky stanovenými zvláštním právním předpisem. 11)
(7) Veterinární lékař je oprávněn požádat výrobce o zajištění kopií z vyhotovení předpisu pro medikované krmivo, které veterinární lékař předává výrobci medikovaného krmiva podle odstavce 2 , za účelem jejich předání v souladu s odstavci 3 a 4; tuto skutečnost uvádí veterinární lékař na předpisu pro medikované krmivo. V tomto případě vypracovává veterinární lékař pouze dvě vyhotovení předpisu pro medikované krmivo.
(8) Výrobce při pořizování kopií z předaného předpisu pro medikované krmivo podle odstavce 7 zajistí, že údaje uvedené na předpisu zůstávají čitelné, a vyloučí provádění jakýchkoliv změn v údajích uvedených v předpisu pro medikované krmivo.
(9) Pro účely předání předpisu pro medikované krmivo příslušné Krajské veterinární správě je výrobce medikovaného krmiva oprávněn využívat prostředků k přenosu dat, například faxového spojení.
(10) V případě, že výrobcem medikovaného krmiva je osoba usazená v jiném členském státě než v České republice a pokud distribuci medikovaného krmiva zajišťuje distributor, může odpovědnost výrobce za zacházení s předpisy pro medikovaná krmiva podle odstavců 2 , 3 a 7 až 9 zajistit distributor medikovaného krmiva. Tím není dotčena povinnost veterinárního lékaře, aby předal jedno vyhotovení předpisu pro medikované krmivo výrobci medikovaného krmiva.
11) § 6 a 27 vyhlášky č. 296/2000 Sb. , kterou se stanoví správná výrobní praxe, správná distribuční praxe a bližší podmínky povolávání výroby a distribuce léčiv včetně medikovaných krmiv, ve znění vyhlášky č. 256/2003 Sb. ".
37. Za § 14 se vkládá nový § 14a, který včetně nadpisu a poznámky pod čarou č. 12) zní:
"§ 14a Náležitosti předpisů pro veterinární autogenní vakcíny a nakládání s nimi
(1) Předpis pro výrobu veterinární autogenní vakcíny obsahuje nejméně tyto náležitosti:
a) jméno, příjmení a místo podnikání předepisujícího veterinárního lékaře,
b) indikaci (označení onemocnění),
c) označení antigenů či patogenů, ze kterých má být autogenní vakcína vyrobena,
d) označení hospodářství a lokality, ze kterého mají být odebrány antigeny či patogeny pro výrobu veterinární autogenní vakcíny,
e) druh a kategorii zvířat, pro která je veterinární autogenní vakcína určena,
f) množství veterinární autogenní vakcíny, které má být vyrobeno (počet dávek),
g) zvláštní upozornění, které má být uvedeno na obalu či v příbalové informaci veterinární autogenní vakcíny,
h) otisk razítka obsahujícího jméno, příjmení (jmenovku) a místo podnikání předepisujícího veterinárního lékaře; pokud veterinární lékař vykonává odbornou veterinární činnost jako zaměstnanec fyzické či právnické osoby oprávněné vykonávat odbornou veterinární činnost, uvádí se dále jméno, příjmení a místo podnikání této osoby, jde-li o fyzickou osobu, nebo její název a sídlo, jde-li o právnickou osobu, a
i) podpis veterinárního lékaře, který předpis pro veterinární autogenní vakcínu vystavil.
(2) Předpis pro výrobu veterinární autogenní vakcíny vystavuje příslušný ošetřující veterinární lékař ve třech vyhotoveních. Jedno vyhotovení uchovává veterinární lékař, který předpis pro výrobu veterinární autogenní vakcíny předepsal, ostatní dvě vyhotovení předává výrobci veterinární autogenní vakcíny.
(3) Výrobce jedno vyhotovení předpisu pro výrobu veterinární autogenní vakcíny uchovává a jedno vyhotovení předává krajské veterinární správě, v jejímž obvodu působnosti bude veterinární autogenní vakcína použita.
(4) Veterinární lékař, který předpis pro výrobu veterinární autogenní vakcíny vystavil, uchovává vyhotovení předpisu po dobu nejméně pěti roků od data jeho vystavení.
(5) Výrobce veterinárních autogenních vakcín uchovává vyhotovení předpisu pro výrobu autogenní vakcíny v souladu s požadavky stanovenými zvláštním právním předpisem. 12)
(6) Veterinární lékař je oprávněn požádat výrobce veterinární autogenní vakcíny o zajištění kopií z vyhotovení předpisu pro výrobu veterinární autogenní vakcíny, které veterinární lékař předává výrobci veterinární autogenní vakcíny podle odstavce 2 , za účelem jejich předání v souladu s odstavcem 3 ; tuto skutečnost uvádí veterinární lékař na předpisu pro výrobu veterinární autogenní vakcíny. V tomto případě vypracovává veterinární lékař pouze dvě vyhotovení předpisu pro výrobu veterinární autogenní vakcíny.
(7) Pro účely předání předpisu pro výrobu veterinární autogenní vakcíny příslušné Krajské veterinární správě je výrobce veterinární autogenní vakcíny oprávněn využívat prostředků k přenosu dat, například faxového spojení.
12) § 6 vyhlášky č. 296/2000 Sb. ".
"PŘÍLOHA Č. 1 K VYHLÁŠCE Č. 343/1997 SB. VZOR RECEPTURNÍHO TISKOPISU NA LÉČIVÉ PŘÍPRAVKY OBSAHUJÍCÍ OMAMNÉ LÁTKY SKUPINY I A PSYCHOTROPNÍ LÁTKY SKUPINY II JEHO PRVNÍHO I DRUHÉHO PRŮPISU
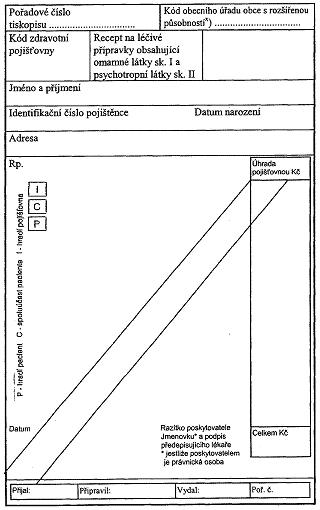
x)
Sdělení Českého statistického úřadu č. 471/2002 Sb., o
zavedení Číselníku obcí s rozšířenou působností (CISORP),
Číselníku obcí s pověřeným obecním úřadem (CISPOU) a
Číselníku správních obvodů hl. m. Prahy (CISSOP).
".
39. Za přílohu č. 2 se doplňuje nová příloha č. 3, která zní:
"PŘÍLOHA Č. 3 K VYHLÁŠCE Č. 343/1997 SB. VZOR RECEPTURNÍHO TISKOPISU PODLE § 1 ODST. 2 PÍSM. A) BODU 2 VYHLÁŠKY Č. 343/1997 SB. , VE ZNĚNÍ VYHLÁŠKY Č. 34/2004 SB.
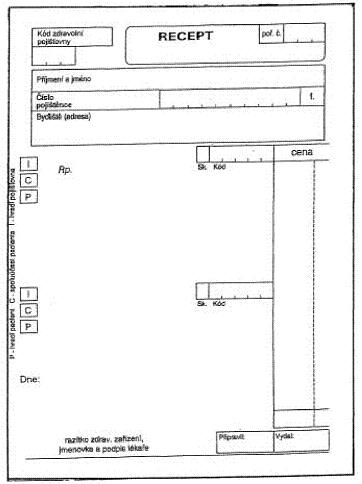
Dosavadní tiskopisy receptů lze používat, pokud budou doplněny o symboly podle § 4 odst. 1 písm. d) bodu 3, do 31. prosince 2005.
Tato vyhláška nabývá účinnosti dnem 1. února 2004, s výjimkou ustanovení bodu 36, pokud jde o § 14 odst. 10, které nabývá účinnosti dnem vstupu smlouvy o přistoupení České republiky k Evropské unii v platnost.
Ministryně: MUDr. Součková v. r.